ایزوتوپ
وقتی دانشمندان با دستگاه طیف سنج جرمی شروع به اندازه گیری جرم اتم های مختلف کردند فهمیدند که همه ی اتم های یک عنصر مشخص جرم یکسانی ندارند.
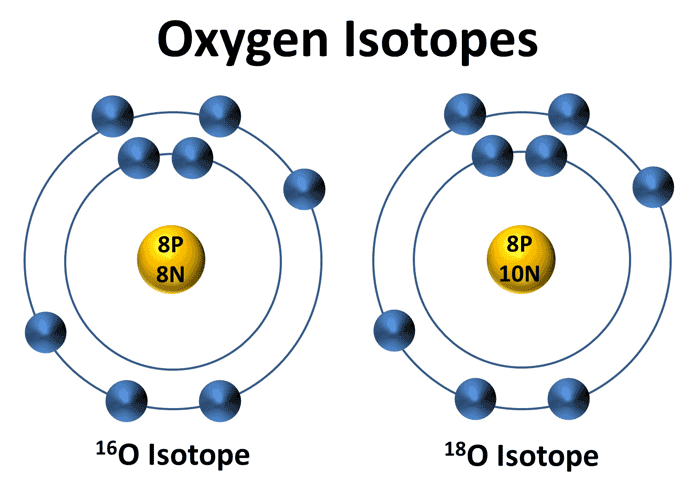
ایزوتوپ ها اتم های یک عنصر هستند که عدد اتمی یکسان ولی عدد جرمی متفاوت دارند.
تعداد پروتون های موجود در همه ی اتم های یک عنصر یکسان است.
پس عامل تفاوت جرم آن ها باید مربوط به تفاوت در تعداد نوترون ها باشد.
چون عدد اتمی ایزوتوپ ها یکسان است پس در جدول تناوبی در یک خانه قرار دارند به همین دلیل به ایزوتوپ ها عنصر های هم مکان هم میگویند.
خواص فیزیکی ایزوتوپ ها با هم متفاوت است اما خواص شیمیایی آن ها مانند هم هست.
تاکنون بیش از 2300 ایزوتوپ مختلف شناخته شده است که از بین آن ها 279 ایزوتوپ پایدار وجود دارد.
مثال:
ایزوتوپ های هیدروژن:

عکس سمت چپ:
هیدروژن معمولی یا پروتیم
این ایزوتوپ هیدروژن نوترون ندارد و در طبیعت فراوان است.
عکس وسط:
هیدروژن سنگین یا دوتریم
این ایزوتوپ هیدروژن یک نوترون دارد.
عکس سمت راست:
هیدروژن پرتوزا یا تریتیم
این ایزوتوپ هیدروژن دو نوترون دارد و ناپایدار است.
به حالت عادی در طبیعت یافت نمیشود.


 فسیل(سنگواره) چیست و عوامل تشکیل و جلوگیری از تشکیل آن
فسیل(سنگواره) چیست و عوامل تشکیل و جلوگیری از تشکیل آن  برخی از کانی های ملی و نحوه کشف و دلیل نامگذاری آنها
برخی از کانی های ملی و نحوه کشف و دلیل نامگذاری آنها  کاربرد برخی از کانی های مهم در زندگی
کاربرد برخی از کانی های مهم در زندگی  انواع محلول(مخلوط همگن)
انواع محلول(مخلوط همگن)  تفاوت های اساسی مخلوط با ترکیب
تفاوت های اساسی مخلوط با ترکیب  انواع مخلوط ها بر اساس اندازه ی ذرات
انواع مخلوط ها بر اساس اندازه ی ذرات  نیکوتین
نیکوتین  مدل اتمی رادرفورد
مدل اتمی رادرفورد  انواع اکسایش
انواع اکسایش  انواع سوختن
انواع سوختن  کلیپ ده آزمایش شیمیایی شگفت انگیز
کلیپ ده آزمایش شیمیایی شگفت انگیز کلیپ آموزش ساخت سه نوع ترقه
کلیپ آموزش ساخت سه نوع ترقه کلیپ نترکیدن بادکنک روی شعله(شمع)
کلیپ نترکیدن بادکنک روی شعله(شمع) کلیپ پرتاب جسم(قوطی فیلم) با قرص جوشان
کلیپ پرتاب جسم(قوطی فیلم) با قرص جوشان کاربرد ها و خطرات کانی نامهربان آزبست(پنبه نسوز)
کاربرد ها و خطرات کانی نامهربان آزبست(پنبه نسوز) سوسپانسیون
سوسپانسیون باریکه و پرتو نور
باریکه و پرتو نور ساختار چشم
ساختار چشم انحلال پذیری مواد جامد در مایع
انحلال پذیری مواد جامد در مایع